Čtvrtek 2. května 2024, stenozáznam části projednávání bodu pořadu schůze
(pokračuje Karel Havlíček)
2.
Vládní návrh zákona, kterým se mění zákon č. 48/1997 Sb.,
o veřejném zdravotním pojištění a o změně a doplnění
některých souvisejících zákonů, ve znění pozdějších předpisů
/sněmovní tisk 669/ - prvé čtení
Z pověření vlády předložený návrh uvede místopředseda vlády a ministr zdravotnictví pan Vlastimil Válek a já ho prosím, aby se ujal slova.
Místopředseda vlády a ministr zdravotnictví ČR Vlastimil Válek: Děkuji, pane předsedající. Tak k vládnímu návrhu, kterým se mění zákonem 48/1997 Sb., o veřejném zdravotním pojištění a o změně a doplnění některých souvisejících zákonů, ve znění pozdějších předpisů. Jedná se o jednoduchý návrh novely o veřejném zdravotním pojištění, jímž se do právního řádu České republiky implementuje evropské nařízení o hodnocení zdravotnických technologií HTA. Je to čistá implementace evropské novely. Toto evropské nařízení stanoví rámec pro podporu spolupráce členských států EU v oblasti klinického hodnocení zdravotnických technologií, a to s cílem dosažení vysoké úrovně ochrany zdraví pacientů a zajištění hladkého fungování vnitřního trhu, pokud jde o humánní léčivé přípravky, zdravotnické prostředky a diagnostické zdravotnické prostředky in vitro. Já to čtu, takže to pak předám samozřejmě tady zapisovatelům, protože mluvím rychle.
Obsahem novely je zejména zajištění výměny informací o hodnocení zdravotnických technologií mezi Českou republikou a ostatními členskými státy Evropské unie. Návrh určuje členy příslušné koordinační skupiny, kterými za Českou republiku budou Ministerstvo zdravotnictví a Státní ústav pro kontrolu léčiv. Návrh dále svěřuje oblasti hodnocení humánních léčivých přípravků do rukou Státního ústavu pro kontrolu léčiv a pověřuje Ministerstvo zdravotnictví, aby do budoucna v rámci rozvoje a prohlubování evropské spolupráce v oblasti hodnocení zdravotnických prostředků určilo osobu, která bude tuto činnost v České republice vykonávat. Jak jsem řekl, jedná se o implementaci.
Místopředseda PSP Karel Havlíček: Děkuji, pane ministře, a poprosím pana zpravodaje Petra Fifku - pane poslanče, abyste se ujal slova. Děkuji.
Poslanec Petr Fifka: Děkuji. Vážené kolegyně, vážení kolegové, pan ministr v podstatě řekl úplně všechno. Jedná se skutečně o transpozici evropské směrnice. Jenom pro možná bližší vysvětlení, takzvané hodnocení zdravotnických technologií neboli HTA je nezbytné proto, že pokrok ve zdravotnických technologií jde neúprosně dopředu a my musíme být schopni sofistikovaně a podle celoevropské metodiky hodnotit přínos těchto nových metod a jejich finanční dopad. Takže je to nesmírně důležité, abychom léčili naše pacienty co nejmoderněji a přitom zachovávali udržitelnost zdravotního systému. Tolik jenom k tomu představení merita. A jenom ještě avizuji, že budu navrhovat zkrácení na projednání lhůty ve výboru o 30 dnů na 30 dnů.
Místopředseda PSP Karel Havlíček: Já vám děkuji a otevírám tímto obecnou rozpravu, do které se přihlásil pan poslanec Kamal Farhan. Máte slovo.
Poslanec Kamal Farhan: Pane předsedající, pane ministře, dámy a pánové, já bych jenom krátce okomentoval tuto novelu. Předložená vládní novela zákona č. 48/1997 Sb. má za cíl adaptovat na český právní řád nařízení Evropské unie 2021/2282, o hodnocení zdravotnických technologií. Toto evropské nařízení si klade za cíl to, co už tady říkal pan ministr, dosáhnout vysoké úrovně ochrany zdraví pacientů a uživatelů a zároveň zajistit hladké fungování vnitřního trhu, pokud jde o humánní léčivé přípravky, zdravotnické prostředky a diagnostické zdravotnické prostředky in vitro. Zároveň stanoví rámec pro podporu spolupráce členských států a opatření potřebných ke klinickému hodnocení zdravotnických technologií.
Samotné hodnocení zdravotnických technologií je proces, který se opírá o vědecké důkazy a který příslušným orgánům umožňuje určit relativní účinnost nových či stávajících zdravotnických technologií. Hodnocení zdravotnických technologií se zaměřuje zejména na přidanou hodnotu zdravotnické technologie v porovnání s jinými, novými či stávajícími zdravotnickými technologiemi.
Veškerá materie právní úpravy je již obsažena ve výše uvedeném evropském nařízení. To je přímo aplikovatelné, tudíž nevyžaduje slovo od slova přepis do českých zákonů, jen je potřeba upravit to, co nařízení nechává na uvážení členských států. V zásadě je tam potřeba pouze stanovit, který z českých státních orgánů bude členem evropské koordinační skupiny pro hodnocení zdravotnických technologií, a tedy který z orgánů bude plnit úkoly stanovené nařízením. Za členy koordinační skupiny pro hodnocení zdravotnických technologií vládní návrh zákona navrhuje stanovit Ministerstvo zdravotnictví a Státní ústav pro kontrolu léčiv. Ministerstvo zdravotnictví je ústředním správním orgánem pro oblast zdravotních služeb, Státní ústav pro kontrolu léčiv pak klíčový pro oblast humánních léčivých přípravků. Navíc SÚKL byl doposud zástupcem v projektu EUnetHTA zabývajícím se přípravou metodik, které budou v praxi používány i v rámci společného klinického hodnocení podle nařízení, a může tak uplatnit nabyté zkušenosti.
Koordinační skupina pro hodnocení zdravotnických technologií bude tedy evropský pracovní orgán, který se bude sestávat z odborníků z ministerstev či lékových agentur napříč Evropskou unií, a jejich cílem bude společně zhodnotit relativní účinnost nových léků a zdravotnických prostředků, a to takových, které představují řešení neuspokojivých léčebných potřeb. Jsou první v dané kategorii, mají zásadní dopad na poskytování zdravotních služeb a mají významnou přidanou hodnotu. Jak je budou hodnotit, to stanoví přímo evropské nařízení. Výsledek hodnocení pak bude použit v národních procesech, například při stanovení maximální ceny a úhrady léků ze zdravotního pojištění v procesu správního řízení před Státním ústavem pro kontrolu léčiv.
Pokud žádné společné hodnocení provedeno nebylo, nic se nemění oproti současnému stavu a firmy musí předložit plnou dokumentaci v České republice. Pokud však lék prošel společným hodnocením, není nutné některé podklady, analýzy připravovat pro Českou republiku znovu a Státní ústav pro kontrolu léčiv použije výsledek společného hodnocení. To však k ničemu nezavazuje Českou republiku. Státní ústav pro kontrolu léčiv jen po ukončení procesu o stanovení ceny a úhrady musí do 30 dnů informovat evropskou koordinační skupinu, jak zohlednil společné hodnocení. Lhůta pro adaptaci končí 12. 1. 2025.
Krátce bych tady jenom ještě okomentoval, že novela je jednoduchá, což tady zmínil pan ministr, já s ním naprosto souhlasím, že je jednoduchá, pokud by byla přijata jako implementace a v tom stavu, v jakém je. Musíme si však uvědomit, že se jedná o novelu čtyřicetosmičky, takže v tuto chvíli souhlasím s panem ministrem, že je to jednoduchá novela, že pokud by měla vypadat takhle, že by měla hladce projít Sněmovnou, ale je avizováno už několik pozměňovacích návrhů. A já si myslím, že bude záležet, jak ty pozměňovací návrhy de facto ovlivní celý zákon jako takový. Ale to se dozvíme v druhém čtení, pokud opravdu budou podány, nebo nebudou podány. Děkuji.
Místopředseda PSP Karel Havlíček: Děkuji, pane poslanče. A vzhledem k tomu, že... Ano, vidím zde jednu faktickou poznámku. Pan poslanec Brázdil.
Poslanec Milan Brázdil: Budu velmi rychlý. Jenom když je to tak jednoduché, promiňte, ale nerozumím tomu, proč se to nedalo v devadesátce? Tím by žádné možnosti dávat tam nějaké pozměňováky nebyly. My bychom to na první dali a byl by klid. Ale tady pravděpodobně se něco chystá. Tak tomu nerozumím. Vždyť ta vláda to mohla dát do devadesátky a už dneska to mohlo být hotové. (Ministr reaguje mimo mikrofon.) Chybička. Pardon. Chybička.
Místopředseda PSP Karel Havlíček: Děkuji vám. Vzhledem k tomu, že nevidím někoho dalšího do rozpravy, tak tímto končím obecnou rozpravu. Pane ministře, máte zájem o závěrečné slovo? Nikoliv. Pan zpravodaj? Ano.
Poslanec Petr Fifka: Jenom tedy formálně podávám návrh na zkrácení lhůty na projednání mezi prvním a druhým čtením ve výboru o 30 dnů na 30 dnů.
Místopředseda PSP Karel Havlíček: Děkuji. Mám poznamenáno. Mezitím už jsem zagongoval, abychom se nezdržovali, a budeme se zabývat návrhem na přikázání výborům k projednání, přičemž rozhodneme nejdříve o garančním výboru. Organizační výbor navrhl přikázat předložený návrh k projednání výboru pro zdravotnictví jakožto výboru garančnímu. Navrhuje někdo přikázání jinému výboru jakožto garančnímu? Nevidím nikoho. V tom případě přistoupíme k hlasování.
Zahajuji hlasování. Táži se, kdo je pro garanční výbor jakožto výbor zdravotní? Kdo je proti?
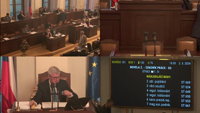
Hlasování číslo 9, přihlášeno 144, pro bylo 104, nikdo nebyl proti. Přijato. Konstatuji, že návrh byl přikázán k projednání zdravotnímu výboru jakožto garančnímu.
Žádný další návrh na přikázání k jinému výboru zde nemáme z organizačního výboru. Má někdo nějaký návrh? Nemá. V tom případě půjdeme na hlasování, které bylo... Ano. Vidím, že je zde zájem o odhlášení. Poprosím o přihlášení.
Budeme hlasovat za chvíli o zkrácení lhůty o 30 dní na 30 dní.
Zahajuji hlasování. Kdo je pro? Kdo je proti?
Hlasování číslo 10, přihlášeno 114, pro bylo 61, proti byl 1. Přijato.
Vyčerpali jsme vše z tohoto bodu. Děkuji vám za spolupráci a můžeme přejít k dalšímu bodu - bodu číslo 3.
Aktualizováno 19. 10. 2025 v 9:21.